Western Blot条带异常常见原因及建议
发布时间:2025-07-03
浏览次数:17633
作者:东极药物
问题一:无条带或信号弱【原因】1.转膜不充分2.PVDF膜未激活3.一抗不识别检测物种的蛋白4.一抗和二抗不匹配5.没有足够的一抗或二抗结合目标蛋白6.抗原量不足7.组织中目的蛋白含量低【建议】1.检查蛋白转移的效率和时···
问题一:无条带或信号弱

【原因】
1. 转膜不充分
2. PVDF膜未激活
3. 一抗不识别检测物种的蛋白
4. 一抗和二抗不匹配
5. 没有足够的一抗或二抗结合目标蛋白
6. 抗原量不足
7. 组织中目的蛋白含量低
【建议】
1. 检查蛋白转移的效率和时间是否正确
2. PVDF膜先浸泡在甲醇中激活,再转移到转膜缓冲液中
3. 参照说明书,比对免疫原序列和蛋白序列以确保抗体和目的蛋白会发生反应,设置阳性对照
4. 检查一抗和二抗的种属:二抗需和一抗宿主的物种相同,如一抗来自兔,二抗为抗兔抗体
5. 适当增加抗体浓度,延长4°C孵育时间(如过夜)
6. 每泳道蛋白上样量不低于20~30μg,使用蛋白酶抑制剂并设置阳性对照
7. 参考文献或数据库,确认靶标蛋白是否在待检组织或细胞中表达。如表达量较低,可以浓缩使信号最大化,同时需增加高表达的阳性对照组,避免操作中出现问题
问题二:背景高

【原因】
1. 封闭不充分
2. 洗涤不充分
3. 一抗浓度过高
4. 样品有问题
5. 膜干燥
【建议】
1. 使用新鲜的封闭液,适当延长封闭时间
2. 增加洗涤次数及时间,除去非特异结合
3. 稀释抗体至合适浓度
4. 检查蛋白样品的纯度和质量,建议使用新鲜样品
5. 任何步骤都保证膜有充分的反应液
问题三:非特异性或者弥散性条带

【原因】
1. 细胞传代次数过多,导致蛋白表达模式分化
2. 蛋白被降解
3. 蛋白本身具有多种修饰形式
4. 所检测蛋白存在多重剪接体导致分子量大小不同
5. 蛋白有二聚体或多聚体
6. 样本存在外源转入蛋白
7. 上样量过多
8. 靶蛋白形成多聚体
9. 一抗浓度过高,高浓度时常出现多条蛋白带
10. 二抗浓度过高,高浓度产生非特异性结合
【建议】
1. 用原始或传代少的细胞株,或平行实验
2. 裂解液确保含有蛋白酶抑制剂,蛋白样品提取后-80°C短期保存,避免反复冻融,有条件尽量用新鲜提取的蛋白
3. 查阅文献,确定目的蛋白是否存在多种修饰,如泛素化、糖基化等修饰会让蛋白的条带发生较大的偏移
4. 查阅文献或者通过搜索数据库来确定该蛋白是否存在多种多种长度不同的编码MRNA
5. SDS loading buffer 中现用现加B-巯基乙醇或DTT
6. 检查所用样本是否被转入外源蛋白
7. 根据靶标表达情况,选择合适的上样量通常20~30μg
8. 煮样时,煮沸10分钟,使蛋白质解聚
9. 降低抗体浓度或减少孵育时间
10. 降低抗体浓度,增加二抗对照(不加一抗)
问题四:“微笑”条带

【原因】
1. 凝胶不充分
2. 电压过高
3. 温度过高
4. 电泳速度过快
【建议】
1. 使用4℃过夜后的胶,这样会使胶充分冷却均匀
2. 在跑电泳或者转膜时,一定要根据蛋白的分子量大小选择适宜的电流和电压
3. 甲醇浓度提高,冰浴,减少转膜的时间
4. 检查实验室电压稳定与否,电压不稳会导致电泳速度过快
问题五:拖尾条带

【原因】
1. 蛋白样品溶解度不好
2. 电泳缓冲液重复利用次数过多
3. 分离胶浓度过大
4. 样品降解
【建议】
1. 加样前离心,优化蛋白提取方法,寻找合适的裂解液
2. 建议电泳液和转膜液现用现配,不重复使用
3. 根据蛋白分子量大小选择合适的分离胶浓度
问题六:膜上出现黑点
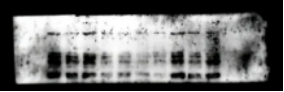
【原因】
1. 膜上其他部位与一抗或二抗非特异性结合
2. 配置的封闭液没有完全溶解,使不溶颗粒附着在膜上形成黑点
3. 抗体与封闭试剂反应
4. HRP偶联二抗中存在聚集体
【建议】
1. 封闭牛奶一定要纯,封闭结束之后要洗
2. 封闭液配置完毕后,需静置
3. 使用前过滤封闭试剂
4. 过滤二抗试剂,去除聚集体
问题七:条带中出现边缘规则的白圈

【原因】
1. 转膜过程中膜和胶之间存在气泡
2. 抗体或底物浓度过高
【建议】
1. 转膜前去掉膜和胶之间的气泡
2. 稀释抗体或发光液
问题八:边缘条带弯曲

【原因】
1. 电泳电流不均
【建议】
1. 更换电泳槽,避免使用凝胶两侧泳道
问题九:条带中间出现白色(反白)

【原因】
1. 样品蛋白浓度过高,导致信号过强
2. 一抗或二抗浓度过高,信号过强,曝光过度,导致反白现象
3. 曝光时间过长,可能导致图像过曝,呈白色发光
【建议】
1. 降低上样量,或者稀释样品
2. 稀释一抗或二抗,根据实际情况判断是哪种试剂浓度过高稀释发光液,可以用TBST或PBS稀释,或者换低敏发光液
问题十:哑铃状条带
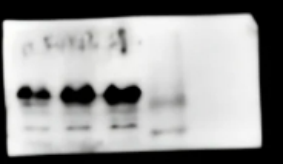
【原因】
1. 胶配制不均
2. 样品含杂质
【建议】
1. 离心去除杂质
2. 现配现用胶
问题十一:条带粘连

【原因】
1. 上样量过大
2. 制胶间隙导致窜孔
【建议】
1. 减少上样量
2. 优化胶体质量
问题十二:某个条带变形
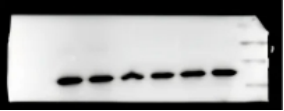
【原因】
1. 胶体中存在气泡
2. 不溶性杂质
3. 胶不均不平整
【建议】
1. 确保配胶时用的小烧杯、水、SDS、tris等干净无杂质
2. 贴边角加入液体,凝固时避免大幅度动作触碰
问题十三:膜上有黑斑

【原因】
1. PVDF/NC 膜存在污染,封闭液污染,封闭膜的容器不干净
2. 未充分激活膜,或者局部激活后又干燥过
【建议】
1. 封闭盒,抗体孵育盒使用前冲洗干净
2. 手套保持干净,尽可能不碰到膜的正面
3. 膜使用前充分激活,由白色变半透明即可使用,不要放置在外面过久使其变干燥
问题十四:蛋白marker被染色
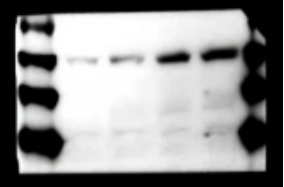
【原因】
1. 一抗与marker非特异性结合
【建议】
1. 条带清晰,更换marker,一抗不用换
2. 若条带不清晰,marker也被染色,建议更换一抗
问题十五:蛋白条带“飘”走了
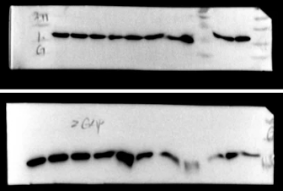
【原因】
1. 三明治结构夹不够紧
2. 转膜过程中放热太多导致蛋白弥散
3. 电源不好用,或电压电流不稳定
【建议】
1. 忌过于松垮、陈旧的转膜夹,务必夹紧后再放入槽中
2. 湿转法使用冰水混合物,湿转液提前预冷1小时左右,可放-20℃
3. 转膜电压用日常使用较稳的电源
文章出自:验外实包 想了解更多请关注:http://www.dj-cro.com/